"Los buceadores que sufren la enfermedad de descompresión tienen una prevalencia de foramen oval permeable (FOP) dos veces superior a la de la población en general".
Tener unas válvulas cardiacas sanas es esencial para que el corazón bombee y haga circular correctamente la sangre por todo el cuerpo. Algunas personas nacen con anomalías estructurales en las válvulas o en las paredes del corazón. Muchos de estos trastornos se diagnostican a una edad temprana y se corrigen, lo que restablece la capacidad de ejercicio de las personas afectadas y les permite bucear con seguridad. Sin embargo, algunos trastornos estructurales congénitos, como una afección conocida como foramen oval permeable, pueden no hacerse evidentes hasta después de que la persona afectada haya empezado a bucear, y pueden dar lugar a un mayor riesgo de determinadas lesiones de buceo. Además, algunas personas sufren más adelante daños valvulares adquiridos que pueden afectar a su aptitud para bucear.
En este capítulo aprenderá sobre:
Información general sobre los desórdenes valvulares
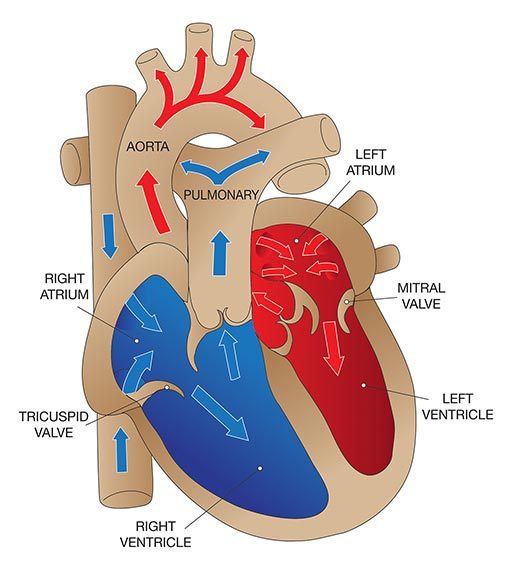
El corazón posee cuatro válvulas principales que facilitan su actividad de bombeo:
- La válvula tricúspide, entre la aurícula y el ventrículo derechos.
- La válvula pulmonar, entre el ventrículo derecho y la arteria pulmonar.
- La válvula mitral, entre la aurícula y el ventrículo izquierdos.
- La válvula aórtica, entre el ventrículo izquierdo y la arteria aorta.
Cada válvula consta de un conjunto de valvas (también llamadas "valvas" o "cúspides") que se abren y cierran para permitir que la sangre fluya en la dirección correcta. La función de las válvulas puede verse comprometida por anomalías congénitas o adquiridas. Los daños en las válvulas pueden deberse a infecciones, fiebre reumática o envejecimiento. Por ejemplo, la abertura de una válvula puede estrecharse (una afección conocida como "estenosis"), lo que significa que el corazón tiene que esforzarse más para hacer pasar la sangre a través de la abertura; esto genera una presión más alta dentro del corazón y, a la larga, provoca el sobredesarrollo del músculo cardiaco. Otro problema valvular frecuente es el cierre incompleto, que permite que la sangre fluya hacia atrás a través de la válvula (una afección conocida como "regurgitación"); esto sobrecarga el corazón de sangre, lo que acaba provocando un agrandamiento (o "dilatación") de las cavidades cardíacas.
Los dos trastornos valvulares más frecuentes en los adultos mayores son la estenosis aórtica y la regurgitación mitral. Los síntomas de los trastornos valvulares varían en función de la válvula afectada, así como del tipo y la gravedad de la alteración. Las alteraciones leves pueden no causar síntomas; un soplo cardíaco -detectado al examinar el corazón con un estetoscopio- suele ser el primer signo de daño valvular. Sin embargo, en la estenosis aórtica, el esfuerzo puede causar dolor torácico (conocido como "angina de pecho") o sensación de opresión en el pecho, falta de aire, desmayos o palpitaciones. A veces, la estenosis aórtica provoca la muerte súbita de atletas por lo demás sanos. La regurgitación también puede causar síntomas detectables, como falta de aire o sibilancias al tumbarse; estas molestias pueden intensificarse con el ejercicio, el aumento de la resistencia a la respiración y la inmersión.
El tratamiento de los desórdenes valvulares, generalmente requiere de cirugía. Las válvulas dañadas pueden repararse o reemplazarse por prótesis.
Prevenir el daño valvular es, por supuesto, la mejor estrategia. Los exámenes físicos de rutina pueden revelar evidencia de enfermedad valvular precoz. En estos casos, se aconseja un seguimiento médico regular y minucioso para identificar, y retrasar el progreso del daño.
Efectos en el buceo
Las anomalías valvulares importantes pueden impedir el buceo hasta que puedan corregirse. Incluso después de la cirugía correctora, debe haber una evaluación de factores tales como la capacidad de ejercicio, la presencia de cualquier regurgitación residual y la necesidad de anticoagulación. Dicha evaluación debe incluir un examen detallado del corazón y de la capacidad del individuo para hacer ejercicio a un nivel compatible con el buceo, sin evidencia de isquemia, sibilancias, disfunción cardiaca o un problema conocido como "derivación de derecha a izquierda."
Prolapso de válvula vitral
El prolapso de la válvula mitral (PVM) también puede denominarse "síndrome del clic-murmullo" o "síndrome de la válvula flácida". Se trata de una afección frecuente, sobre todo en mujeres. El problema surge como consecuencia de un exceso de tejido y tejido conjuntivo laxo en la válvula mitral del corazón, de modo que parte de la válvula sobresale hacia el ventrículo izquierdo durante cada contracción del corazón.
Una persona con PVM puede no presentar absolutamente ningún síntoma o mostrar síntomas que van desde palpitaciones ocasionales o una sensación inusual en el pecho cuando late el corazón, hasta dolor torácico o un infarto de miocardio (o ataque al corazón). El PVM también se asocia a un riesgo ligeramente mayor de sufrir pequeños accidentes cerebrovasculares (conocidos como "ataques isquémicos transitorios") o una pérdida transitoria de conciencia.
Los betabloqueantes -medicamentos utilizados habitualmente para tratar la hipertensión arterial- se prescriben ocasionalmente para el prolapso de la válvula mitral. Suelen provocar un descenso de la capacidad máxima de ejercicio y también pueden afectar a las vías respiratorias. Estos efectos secundarios no suelen suponer un problema para el buceador medio, pero pueden ser importantes en situaciones de emergencia.
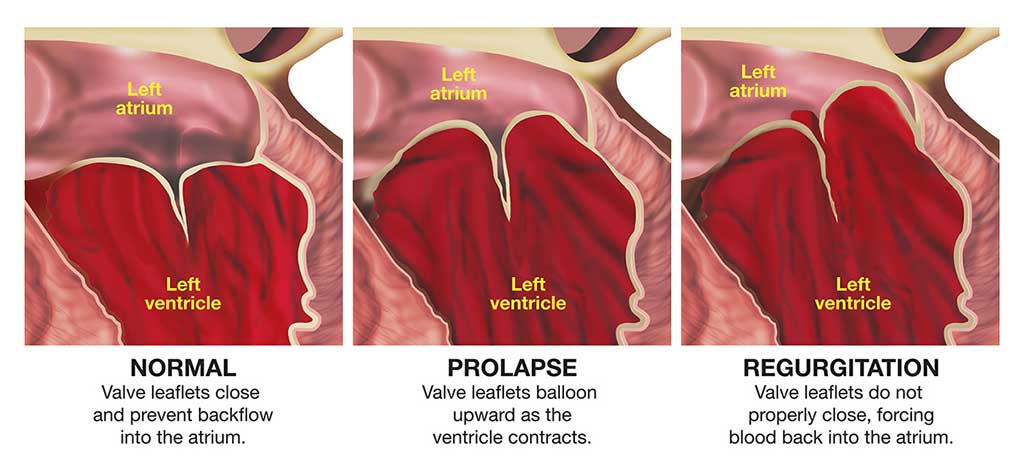
Efectos en el buceo
Con frecuencia, el PVM no provoca cambios en el flujo sanguíneo que pudieran impedir que una persona bucee con seguridad. Un buzo con PVM que no tiene síntomas (es decir, no sufre dolor de pecho, alteración de la conciencia, palpitaciones, o latidos anormales), y que no toma medicación para este problema, debería poder practicar buceo con seguridad. Pero cualquier individuo con PVM que presente ritmo cardíaco anormal, lo que produce palpitaciones, no debería bucear a menos que las mismas puedan controlarse con una baja dosis de medicación contra la arritmia.
Foramen Oval Permeable
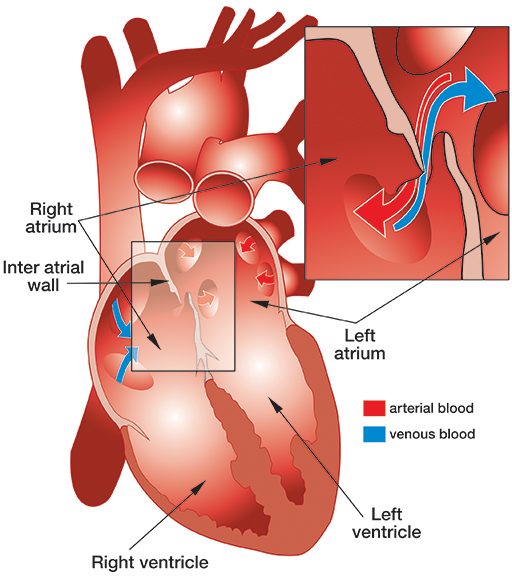
El foramen oval permeable (FOP) es un orificio bastante frecuente, congénito y generalmente benigno entre las aurículas izquierda y derecha del corazón (véase la ilustración).
Mientras el feto se desarrolla en el útero, la pared que separa las aurículas izquierda y derecha del corazón se desarrolla a partir del septum primum, que crece hacia arriba, y el septum secundum, que crece hacia abajo. Los tabiques se superponen, creando una especie de trampilla (conocida como "foramen oval"), que permite el paso a la aurícula izquierda de la sangre oxigenada procedente de la placenta materna que ha entrado en la aurícula derecha del feto. Al nacer, los pulmones del bebé se expanden y la presión resultante en la aurícula izquierda cierra el agujero oval. Normalmente, poco después del nacimiento, este orificio se fusiona, pero en aproximadamente el 27% de los bebés no se fusiona por completo y se produce un FOP.
El FOP suele ser asintomático y la mayoría de las personas que lo padecen nunca son conscientes de ello. El FOP se diagnostica inyectando una pequeña cantidad de aire en una vena y observando su paso por el corazón mediante ecocardiografía. Existen dos métodos de ecocardiografía. La ecocardiografía transtorácica (ETT) es fácil y no invasiva -simplemente consiste en colocar una sonda de ultrasonidos en la pared externa del tórax-, pero sólo detecta un FOP en entre el 10 y el 18% de la población, aproximadamente la mitad de los que probablemente lo tengan. La ecocardiografía transesofágica (ETE), que requiere anestesia local y sedación intravenosa para poder introducir la sonda en el esófago, detecta un FOP entre el 18% y el 33% de la población. Sin embargo, aunque la ETE es más sensible que la ETT, sigue habiendo muchos resultados falsos negativos con ambas técnicas; de hecho, una ETT realizada correctamente puede ser más fiable que una ETE.
Uno de los tratamientos más comunes para el FOP es un procedimiento llamado oclusión transcatéter; implica introducir un catéter a través de la ingle y por la vena femoral hasta el corazón, donde se implanta un dispositivo llamado oclusor, en el FOP. Los oclusores vienen en diferentes formas, pero la mayoría actúa como un paraguas doble que se abre a cada lado de la pared auricular y sella el orificio. Con el tiempo, el tejido crece sobre el oclusor, y cubre completamente su superficie. El implante se realiza con anestesia local y sedación intravenosa, y el paciente está consciente. Dura menos de una hora y puede realizarse de manera ambulatoria o permaneciendo internado una noche. La mayoría de los pacientes pueden retomar sus actividades normales en dos días, pero deben tomar medicamentos anticoagulantes y/o anti agregantes plaquetarios durante tres a seis meses. Otras restricciones postoperatorias incluyen tratamientos dentales no opcionales (como las limpiezas) durante tres meses, práctica de deportes de contacto por tres meses, y no levantar objetos pesados por una semana. Un buzo que se somete a una oclusión transcatéter de FOP debe abstenerse de bucear durante tres a seis meses.
No hay información disponible sobre los resultados de la oclusión del FOP en buzos. Pero se hallaron los siguientes resultados en pacientes que se sometieron a la misma como prevención de un accidente cerebro vascular (ACV) (nótese, sin embargo, que estos pacientes sufrían de condiciones médicas subyacentes que podían contribuir a un riesgo de resultados adversos mayor que el promedio):
- Eficacia: La oclusión completa de la apertura se logró en el 95% de los casos, y la incompleta en 4% a 5% de los casos; sólo en el 1% de los casos no se demostró mejoría.
- Complicaciones: La mortalidad general fue menor a 1/10 del 1% (0,093%). La necesidad de una operación posterior debido a un evento adverso asociado con el dispositivo fue menor al 1% (0,83%).
- Complicaciones Graves: La incidencia de muerte, accidente cerebro vascular (ACV), infección, sangrado, o lesión de los vasos sanguíneos fue del 0,2%; de movimiento o desplazamiento del dispositivo, 0,25%; de formación de coágulos en el dispositivo, 0, 3%; de complicaciones más importantes en el período perioperatorio, 12%; y de complicaciones menores en el mediano plazo, 2,4%.
Efectos en el buceo
Los buzos que sufren enfermedad descompresiva (EDC) tienen el doble de prevalencia de Foramen Oval Permeable (FOP) que la población en general. Y en buzos que manifiestan síntomas neurológicos de EDC, la frecuencia es cuatro veces mayor. El riesgo de EDC parece aumentar con el tamaño del FOP. Basado en estos hechos, se supone que los buzos con un FOP tienen mayor riesgo de sufrir EDC que los que no lo tienen; sin embargo, el único estudio probable diseñado para medir directamente el riesgo relativo de EDC en buzos con un FOP aún está en curso.
Siguiente: Capítulo 4 - Cardiopatía isquémica >