“Divers who suffer decompression sickness have a patent foramen ovale (PFO) prevalence twice that of the population in general.”
Having healthy heart valves is essential if your heart is to properly pump and circulate blood throughout your body. Some people are born with structural anomalies in their heart valves or in the walls. Many such disorders are diagnosed early in life and corrected, restoring the affected individuals’ exercise capacity and enabling them to dive safely. However, some inborn structural disorders, like a condition known as patent foramen ovale, may not become obvious until after an affected individual has taken up diving — and may result in an increased risk of certain diving injuries. In addition, some people are impacted later in life by acquired valvular damage that may affect their fitness to dive.
Dans ce chapitre, vous découvrirez
Aperçu des troubles valvulaires
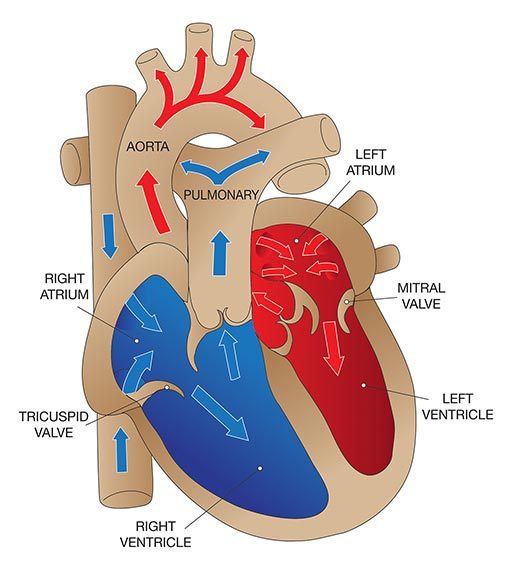
Le cœur possède quatre valves principales qui facilitent l'activité de pompage du cœur :
- La valve tricuspide, entre l'oreillette droite et le ventricule droit.
- La valve pulmonaire, entre le ventricule droit et l'artère pulmonaire.
- La valve mitrale, entre l'oreillette gauche et le ventricule gauche.
- La valve aortique, entre le ventricule gauche et l'aorte.
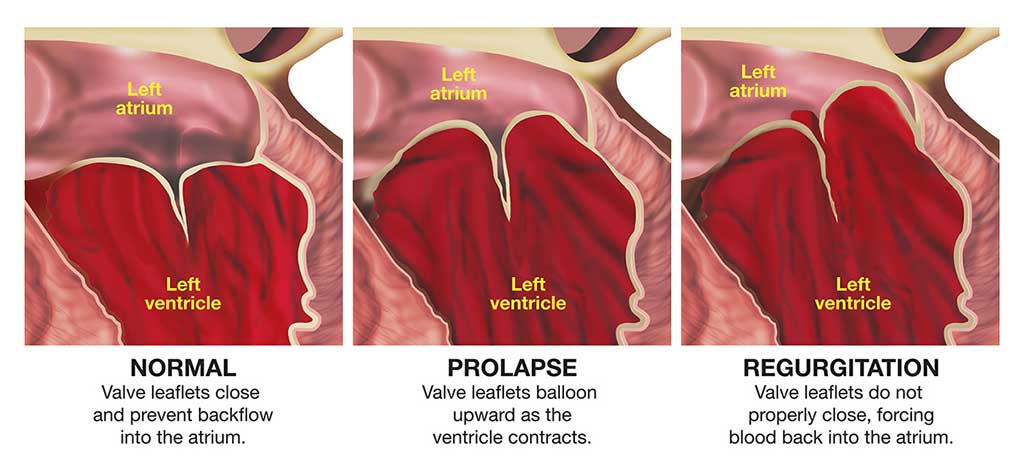
Each valve consists of a set of flaps (also called “leaflets” or “cusps”) that open and close to enable blood to flow in the correct direction. The function of the valves may be compromised by either congenital or acquired abnormalities. Damage to the valves can occur due to infection, rheumatic fever or aging. For example, the opening in a valve may narrow (a condition known as “stenosis”), meaning the heart has to work harder to get blood through the opening; this generates higher pressure within the heart and eventually causes the cardiac muscle to overdevelop. Another common valvular problem is incomplete closure, which allows the blood to flow backward through the valve (a condition known as “regurgitation”); this overloads the heart with blood, eventually resulting in enlargement (or “dilatation”) of the heart’s cavities.
The two most common valvular disorders in older adults are aortic stenosis and mitral regurgitation. The symptoms of valvular disorders vary depending on which valve is affected as well as on the type and severity of the change. Mild changes may cause no symptoms; a heart murmur — detected when the heart is examined with a stethoscope — is often the first sign of valve damage. In aortic stenosis, however, exertion can cause chest pain (known as “angina”) or a feeling of tightness in the chest, shortness of breath, fainting or heart palpitations. Sudden death in otherwise healthy athletes is sometimes caused by aortic stenosis. Regurgitation can also cause detectable symptoms, such as shortness of breath or wheezing when lying down; these complaints may be intensified by exercise, increased resistance to breathing and immersion.
Le traitement des troubles valvulaires implique généralement une intervention chirurgicale. Les valves défectueuses peuvent être réparées ou remplacées par des prothèses.
La prévention des lésions valvulaires est, bien entendu, la meilleure approche. Les examens physiques de routine peuvent révéler des signes de maladie valvulaire précoce. Dans ce cas, une surveillance médicale étroite et régulière est conseillée afin d'identifier et, espérons-le, de ralentir la progression de la maladie.
Effet sur la plongée
Significant valvular anomalies may preclude diving until they can be corrected. Even after corrective surgery, there must be an assessment of such factors as exercise capacity, the presence of any residual regurgitation and the need for anticoagulation. Such an assessment should include a detailed examination of the heart and of the individual’s ability to exercise at a level consistent with diving, without evidence of ischemia, wheezing, cardiac dysfunction or a problem known as “right-to-left shunting.”
Prolapsus de la valvule mitrale
Mitral valve prolapse (MVP) may also be referred to as “click-murmur syndrome” or “floppy-valve syndrome.” It is a common condition, especially in women. The problem arises as a result of excess tissue and loose connective tissue in the heart’s mitral valve, so that part of the valve protrudes down into the left ventricle during each contraction of the heart.
An individual with MVP may have absolutely no symptoms or may exhibit symptoms ranging from occasional palpitations or an unusual feeling in the chest when the heart beats, to chest pain or a myocardial infarction (or heart attack). MVP is also associated with a slightly increased risk of small strokes (known as “transient ischemic attacks”) or a transient loss of consciousness.
Beta blockers — drugs commonly used to treat high blood pressure — are occasionally prescribed for mitral valve prolapse. They often cause a drop in maximum exercise capacity and may also affect the airways. These side effects normally pose no problem for the average diver, but they may be significant in emergency situations.
Effet sur la plongée
Souvent, le MVP n'entraîne aucune modification de la circulation sanguine susceptible d'empêcher un individu de plonger en toute sécurité. Un plongeur atteint de MVP qui ne présente aucun symptôme (c'est-à-dire aucune douleur thoracique, aucun trouble de la conscience, aucune palpitation ni aucun rythme cardiaque anormal) et qui ne prend aucun médicament pour ce problème peut plonger en toute sécurité. En revanche, une personne atteinte de MVP qui présente un rythme cardiaque anormal, susceptible de provoquer des palpitations, ne doit pas plonger, sauf si les palpitations peuvent être contrôlées par une faible dose de médicaments antiarythmiques.
Foramen ovale patent
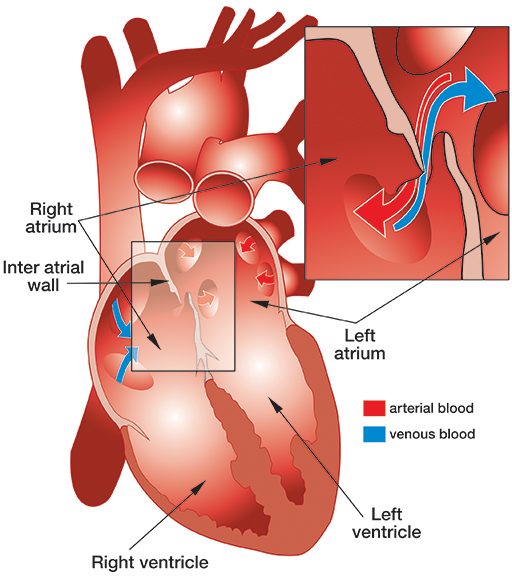
Patent foramen ovale (PFO) is a fairly common, congenital, generally benign hole between the heart’s left and right atria (see illustration).
While a fetus is developing in utero, the wall separating the left and right atria of the heart develops from the septum primum, which grows up, and septum secundum, which grows down. The septa overlap, creating a sort of trap door (known as the “foramen ovale”), which allows oxygenated blood from the mother’s placenta that has entered the fetus’ right atrium to pass through to its left atrium. At birth, the baby’s lungs expand, and the resulting pressure in the left atrium closes the foramen ovale. Typically, shortly after birth, this former opening fuses shut — but in about 27 percent of babies, it fails to fuse completely and results in a PFO.
A PFO often causes no symptoms, and most people who have one are never aware of the fact. PFO is diagnosed by injecting a small amount of air into a vein and observing its passage through the heart using echocardiography. There are two methods of echocardiography. Transthoracic echocardiography (TTE) is easy and noninvasive — it involves simply placing an ultrasound probe on the outer wall of chest — but it detects a PFO in only 10 percent to 18 percent of the population — about half of those who probably have one. Transesophageal echocardiography (TEE) — which involves local anesthesia and intravenous sedation, so the probe can be passed into the esophagus — detects a PFO in 18 percent to 33 percent of the population. However, even though TEE is more sensitive than TTE, there are still many false-negative results with both techniques; a properly conducted TTE may in fact be more reliable than a TEE.
L'un des traitements les plus courants du FOP est une procédure appelée fermeture transcathéter ; elle consiste à faire passer un cathéter par l'aine et la veine fémorale jusqu'au cœur, où un dispositif appelé occluder est implanté à travers le FOP. Les occludeurs se présentent sous différentes formes, mais la plupart agissent comme un double parapluie qui s'ouvre de chaque côté de la paroi auriculaire et scelle le trou. Avec le temps, le tissu se développe sur l'occluder et recouvre complètement sa surface. L'implantation est réalisée sous anesthésie locale et sédation intraveineuse, le patient restant conscient. Elle dure moins d'une heure et peut être réalisée en ambulatoire ou avec un séjour d'une nuit. La plupart des patients peuvent reprendre leurs activités normales au bout de deux jours, mais ils doivent prendre des médicaments anticoagulants et/ou antiplaquettaires pendant trois à six mois. Parmi les autres restrictions postopératoires, citons l'absence de soins dentaires non urgents (tels que les nettoyages) pendant trois mois, l'absence de sports de contact pendant trois mois et l'absence de port de charges lourdes pendant une semaine. Un plongeur qui subit une fermeture transcathéter du FOP doit s'abstenir de plonger pendant trois à six mois.
Aucune donnée n'est disponible sur les résultats de la fermeture du FOP chez les plongeurs. Mais les résultats suivants ont été enregistrés chez des patients ayant subi une fermeture du FOP pour la prévention d'un accident vasculaire cérébral (il convient toutefois de noter que ces patients présentent des conditions médicales sous-jacentes qui peuvent contribuer à un risque plus élevé que la moyenne de résultats défavorables) :
- Efficacité : La fermeture complète de l'ouverture a été obtenue dans 95 % des cas et la fermeture incomplète dans 4 à 5 % des cas ; aucune amélioration n'a été constatée dans seulement 1 % des cas.
- Complications : La mortalité globale était inférieure à 1/10e de 1 % (0,093 %). La nécessité d'une opération de suivi en raison d'un événement indésirable associé au dispositif était inférieure à 1 % (0,83 %).
- Complications graves : L'incidence des décès, des accidents vasculaires cérébraux, des infections, des hémorragies ou des lésions des vaisseaux sanguins était de 0,2 % ; celle des mouvements ou des déplacements du dispositif, de 0,25 % ; celle de la formation de caillots sur le dispositif, de 0,3 % ; celle des complications majeures dans la période périopératoire, de 1,2 % ; et celle des complications mineures à moyen terme, de 2,4 %.
Effet sur la plongée
Les plongeurs qui souffrent d'un accident de décompression (DCS) ont une prévalence de FOP deux fois supérieure à celle de la population en général. Chez les plongeurs qui présentent des symptômes neurologiques de DCS, la prévalence du FOP est quatre fois plus élevée. Le risque de DCS semble augmenter avec la taille du PFO. Sur la base de ces faits, on suppose que les plongeurs avec un PFO sont plus exposés au risque de DCS que ceux qui n'ont pas de PFO ; cependant, la seule étude prospective conçue pour mesurer directement le risque relatif de DCS chez les plongeurs avec un PFO est toujours en cours.
Suivant : Chapter 4 – Ischemic Heart Disease >